Método Kjeldahl
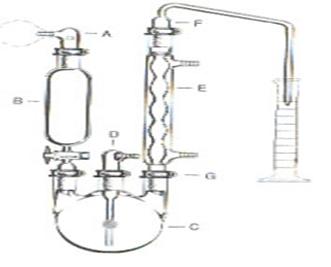
Fundamento
Este método se basa en la descomposición de los compuestos de nitrógeno orgánico por ebullición con ácido sulfúrico. El hidrógeno y el carbón de la materia orgánica se oxidan para formar agua y bióxido de carbono. El ácido sulfúrico se transforma en SO2, el cual reduce el material nitrogenado a sulfato de amonio.
El amoniaco se libera después de la adición de hidróxido de sodio y se destila recibiéndose en una disolución al 2% de ácido bórico. Se titula el nitrógeno amoniacal con una disolución valorada de ácido, cuya normalidad depende de la cantidad de nitrógeno que contenga la muestra. En este método de Kjeldahl-Gunning se usa el sulfato de cobre como catalizador y el sulfato de sodio para aumentar la temperatura de la mezcla y acelerar la digestión.
MATERIALES Y REACTIVOS
Materiales
- El equipo de vidrio empleado debe cumplir con los requisitos que establece la
NMX-BB-014.
- Matraces Kjeldahl de 500 y/o 800 cm3
- Material común de laboratorio
Reactivos
Los reactivos que se mencionan a continuación, deben ser grado analítico, cuando se indique agua, debe entenderse agua destilada.
- Ácido sulfúrico concentrado
- Sulfato de cobre pentahidratado
- Zinc granulado
- Hidróxido de sodio: Disolver con 500 cm3 de agua 500 g de hidróxido de sodio.
- Sulfato de sodio anhidro
- Ácido bórico al 2%
- Solución de ácido clorhídrico 0.1 N
- Indicador Shiro Tashiro: Disolver 0.2 g de rojo de metilo en 60 cm3 de alcohol y aforar a 100 cm3 con agua. Disolver 0.2 g de azul de metileno y aforarlos a 100 cm3 con agua. Mezclar 2 partes de rojo de metilo y una de azul de metileno.
APARATOS E INSTRUMENTOS
- Digestor y destilador Kjeldahl
- Balanza analítica con ± 0.1 mg de sensibilidad
PROCEDIMIENTO
1 Determinar la masa, en la balanza analítica, de aproximadamente un gramo de muestra y pasarla cuantitativamente a un matraz Kjeldahl, añadirle 2 g de sulfato de cobre, 10 g de sulfato de sodio anhidro, 25 cm3 de ácido sulfúrico y unas perlas de vidrio.
2 Colocar el matraz en el digestor y calentar cuidadosamente a baja temperatura hasta que todo el material esté carbonizado, aumentar gradualmente la temperatura hasta que la disolución esté completamente clara y dejar por 30 minutos más a esa temperatura.
3 Enfriar y añadir de 400 a 450 cm3 de agua para disolver completamente la muestra, agregar 3 ó 4 gránulos de zinc, un poco de parafina cuando sea necesario y 50 cm3 de hidróxido de sodio 1:1.
4 Inmediatamente conectar el matraz a un sistema de destilación, el cual previamente se le ha colocado en la salida del refrigerante un matraz Erlenmeyer de 500 cm3 que contenga 50 cm3 de ácido bórico y unas gotas del reactivo Shiro Tashiro como indicador.
5 Destilar hasta que haya pasado todo el amoniaco, que unas gotas de destilado no den alcalinidad con el papel tornasol, aproximadamente 300 cm3.
NOTA: Las primeras gotas de destilado deben hacer virar el color del indicador de violeta a verde.
6 Retirar el matraz recibidor y titular el destilado con ácido clorhídrico 0.1 N.
EXPRESIÓN DE RESULTADOS
.El Nitrógeno presente en la muestra, expresado en por ciento se calcula mediante la siguiente fórmula:
V x N x 0.014 x 100
% de nitrógeno =
m
En donde:
V = Volumen de ácido clorhídrico empleado en la titulación, en cm3
N = Normalidad del ácido clorhídrico.
m = Masa de la muestra en g.
0.014 = Miliequivalente del nitrógeno.
El por ciento de proteínas se obtiene multiplicando el por ciento de nitrógeno obtenido por el factor correspondiente 6.25
El contenido de nitrógeno en diferentes proteínas es aproximadamente de 16% por lo que multiplicando el por ciento de nitrógeno obtenido por el factor 6.25 se obtiene la cantidad de proteínas presentes en el alimento. Sin embargo, en algunos productos, la relación nitrógeno-proteínas varía en forma transcendente por lo que es necesario utilizar los factores que en ese caso se señalen:
5.7 Pan y trigo
5.95 Arroz
6.31 Germen de trigo
6.25 Maíz
6.71 Soya
5.70 Cereales y pastas
6.38 Leche
Absorción a 280 nm.
La mayoría de las proteínas muestran una absorción a 280 nm, la cual se atribuye al grupo fenólico de la tirosina y al grupo indólico del triptofano. La cuantificación de proteínas basada en la absorción en la región de UV, tiene la ventaja de que no es necesario utilizar reactivos y la muestra no se daña o destruye durante la determinación. Se toma en cuenta la absorción del disolvente, ya que este puede absorber en la misma región. Este método sufre interferencias de compuestos que contengan anillos de purina y pirimida. Se realiza una comparación con una proteína estándar, de la que se debe conocer su composición. (Mollet, 1996)
Método de Biuret
El método comprende un ensayo calorimétrico de un paso donde se cuantifica la formación de un complejo estable entre proteínas y cobre (II). El complejo presenta un color violeta característico, que se puede observar a 310nm o 540-560nm, el cual se da por la coordinación de un átomo de cobre con cuatro átomos de nitrógeno. El complejo se basa en la desprotonación de los grupos amida para formar el enlace con el cobre (II) o por el establecimiento de un enlace coordinado entre el metal y los pares de electrones libres de los átomos de oxigeno y de nitrógeno del péptido. Después de la adición del reactivo de cobre se requiere de tiempo para desarrollar una coloración de Biuret estable; es necesario considerar la posible influencia de aminoácidos libres que forman buffer en configuración tris y amoniaco. (Nollet, 1996)
Método de Lowry
Se basa en la reducción del reactivo de Folin-Ciocalteau que es una mezcla de ácidos fosfomolibdico y fosfotungstico por la oxidación de tirosina, triptofano, cisterna, cistina de las cadenas polipeptídicas. El proceso de oxido-reducción se acompaña de la formación de un color azul característico. Quelatos de cobre en la estructura del péptido facilitan la transferencia de electrones de los grupos funcionales amino al cromógeno ácido. Este método es útil para determinar pequeñas cantidades de proteína en una disolución. El desarrollo de color es dependiente en gran cantidad del pH, que se debe mantener entre 10 y 10.5. (Nollet, 1996)
Especies reducidas de Coloración azul
Ventajas y desventajas de los métodos de determinación de proteínas
Método
|
Ventajas
|
Desventajas
|
Método de Kjeldahl
|
_ Es apropiado para varios
tipos de productos
_ Su alta confiabilidad y
disponibilidad
_ Esta incluido en los
métodos aprobados por
las organizaciones
internacionales
|
_ Llega haber
interferencia de
compuestos
nitrogenados no
proteicos
_ Durante la digestión se
produce demasiado
humo
_ Uso de catalizadores
caros o tóxicos
_ Baja sensibilidad
_ Tarda demasiado
tiempo
|
Absorción a 280nm
|
_ Rápida y no destructiva
_ No se necesitan reactivos
_ Alta sensibilidad
_ Baja dependencia de la
respuesta de la señal a la
composición del
aminoácido
_ Baja interferencia de
ácidos nucleicos y
nucleótidos
|
_ La interferencia de
otros compuestos que
absorban en UV
_ Se necesita usar
muestras limpias y
lámparas
relativamente nuevas
|
Método de Biuret
|
_ No hay interferencia de
aminoácidos libres
_ Pequeña influencia de la
composición del
aminoácido en el
desarrollo de color
_ La operación es simple y
se puede manejar
numero grande de
muestras
|
_ Interferencia de
amoniaco, buffer,
detergentes
_ Baja sensibilidad
|
Método de Lowry
|
_ Alta sensibilidad
_ Fácil de operar
_ Fácil de manejar un gran
numero de muestras
|
_ Dependencia del color
con la composición del
aminoácido
_ Interfieren un buen
numero de compuestos
_ Inestabilidad del
reactivo Folin-
Ciocalteau a pH
alcalino
_ La curva estándar no es
lineal para altas
concentraciones de
proteínas
|
Bibliografía
- NMX-F-068-S-1980. ALIMENTOS. DETERMINACIÓN DE PROTEÍNAS. FOODS. DETERMINATION OF PROTEINS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
- Manual de fundamentos y técnicas de análisis de alimentos 2007-2008
No hay comentarios:
Publicar un comentario